last update 2006.05.22
さて、いよいよランタノイドに見られる大変興味深い現象、四つ組(テトラド)効果についてみていきましょう。それは1960年代、希土類元素の溶媒抽出系における分配係数の不連続性の発見から始まりました。四つ組(テトラド)効果そのものの存在を疑問視する人は多いのですが、理論的に否定してくる人はほとんどいません(atomicな電子雲拡大効果で説明するのではなく、分子軌道論的に解釈するべきでは?と指摘する人はいますが・・・)。四つ組(テトラド)効果とは一体?
希土類元素の化学的な性質におかしな挙動が見られることが分かったのは、Fidelis and Siekierski, 1966, J. Inorg. Nucl. Chem. 28, 185-188.やPeppard, D.F. et al., 1969, J. Inorg. Nucl. Chem. 31, 2271-2272 らの報告が最初でしょう。彼らはランタノイドイオンの溶媒抽出の分配係数がなめらかな曲線ではなく、Gdを軸とした左右対照的なパターンを示すこと(ガドリニウムブレイクとも呼ばれています)やLa-Nd, Pm-Gd, Gd-Ho, Er-Lu の4つ毎に繰り返しパターンが見られることを見いだしました(右図参照)。四つ組(テトラド)効果(tetrad effect)とは、Peppard らが言い始めたもので、60年代後半にいくつかのテトラド効果についての報告を行っています。
希土類元素イオン、特にランタノイドイオンは原子番号が増加するにしたがって、イオン半径がなめらかに変化することから(「希土類元素って?」の<ランタニド収縮>を参照)、溶媒抽出の分配係数も原子番号が増加するにしたがって、右図の赤点線のようになめらかに増減する事が予想されます。ところが、この予想を裏切って、次から次へとなめらかな変化を示さない例が見つかったのです。
はじめは直感的(見たまま)の現象論の報告だったのですが、すぐにPeppard らの論文を読んだ、Jørgensen, C. K. 1970, J. Inorg. Nucl. Chem. 32, 3127-3128.やNugent L. J., 1970, J. Inorg. Nucl. Chem. 32, 3485-3491.によって、溶媒抽出データに認められた四つ組(テトラド)効果は、Jørgensen が1960年代前半に発表した、ランタノイドイオンの分光理論式に表れた電子雲拡大効果(nephelauxetic effect)であるとの指摘がほぼ同時になされました。理論的な解説については、後ほど詳しく行います。
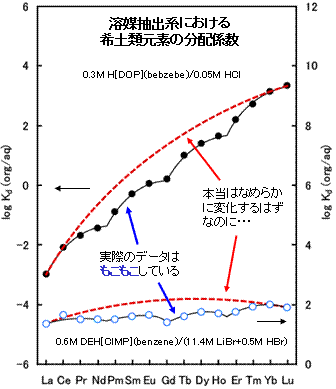
図の説明:二つの溶媒抽出データは、Peppard, D.F. et al., 1969, J. Inorg. Nucl. Chem. 31, 2271-2272; Kawabe and Masuda, 2001, Geochem. J. 35, 215-224.より引用。縦軸は分配係数の常用対数で表示している。
補足説明:
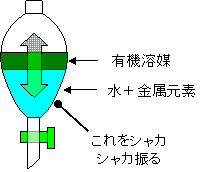
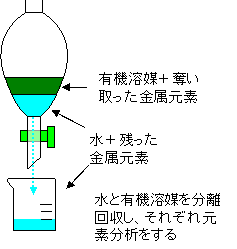
ここで少し溶媒抽出について説明しましょう。溶媒と呼ばれる有機物のなかには、希土類元素をはじめとする金属元素と強く結合するものがあります。この溶媒は水に溶けない性質を持っています。この溶媒を金属元素が溶けている水に加え、激しく振ると、水に溶けていた金属元素が溶媒にくっついて取り除かれます。溶媒は水に溶けないので、水から金属元素を容易に分離することができます。ただし、溶媒への取り除かれやすさは金属元素の種類によって異なります。どのくらい、水から溶媒に取り除かれやすいかを表す値が分配係数です。分配係数は、溶媒を金属元素が溶けている水に加え振るった後、溶媒に移った元素の濃度を水に残った(取り除かれ損ねた)元素の濃度で割った値の事です。

Peppardらの報告から、溶媒抽出のデータでは比較的(?)受け入れられてきた四つ組(テトラド)効果ですが、地球物質にも四つ組(テトラド)効果があることを見いだしたのは、「Masuda-Coryel プロット」で有名な増田(神戸大学時代)によります。かれらは、海水や花崗岩の希土類元素存在度パターンに四つ組(テトラド)効果が見られることを最初に指摘しました(Masuda and Ikeuchi, 1979, Geochem. J. 13, 19-22; Masuda et al., 1987,Geochem. J. 21, 119-124)。実際にデータを見てみましょう。
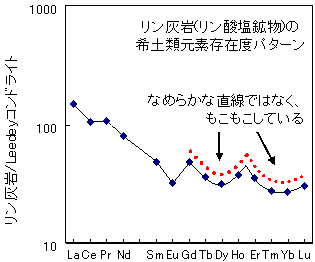
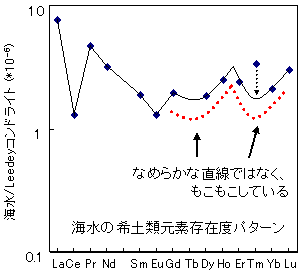
図の説明:データはMasuda and Ikeuchi, 1979, Geochem. J. 13, 19-22.より引用。
海水とリン灰岩のデータは、Goldberg et al., 1963, J. Geophys. Res. 68, 4209-4217.
いずれも、重希土類元素に下側に湾曲したパターンが認められる。
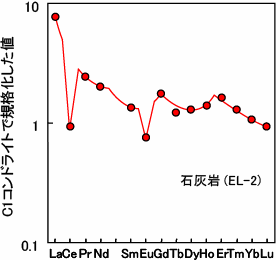
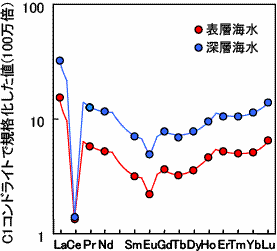
ずいぶん歯抜けのデータから、よくぞ四つ組(テトラド)効果が見られると言ったものだと思います。しかし、かれらの主張の最も重要な点は、Peppardと同様に、希土類元素存在度パターンがなめらか直線又は曲線を描くはずだという当時の常識を否定したことではないでしょうか。当時の希土類元素分析技術はまだ低く充分なデータが得られない時期の発表であったことや、非常に分析精度の高い同位体希釈法と呼ばれる分析方法では、Pr(プラセオジム)、Tb(テルビウム)、Ho(ホルミウム)などの元素が測定できず歯抜けデータであること等から、必ずしも主張が認められたわけではありませんでした。しかし、その後、川邊(愛媛大学時代)によってJørgensen理論式(分光理論 Jørgensen, 1979, Handbook on the Physics and Chemistry of Rare Earths vol.3, 111-169.など)の熱力学データへの適応化が試みられました(Kawabe, 1992, Geochem. J. 26, 309-335.)。ここで初めて四つ組(テトラド)効果の物理化学的な意味づけがなされ、次々と報告例がなされました(下図参照)。このように、地球化学の分野では、日本人の研究者が深く関わっています。
 |
 |
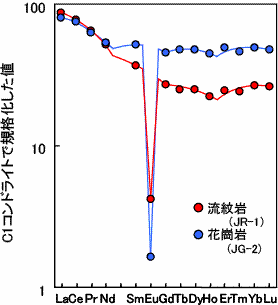 |
| 海の化学的堆積物(石灰岩)に、はっきりと下に凸(W型)の四つ組(テトラド)効果が認められる。 | 増田の報告と同様に、海水にも下に凸(W型)の四つ組(テトラド)効果が見られる。 | 流紋岩や花崗岩といった岩石には、上に凸(W型)の四つ組(テトラド)効果が見られる。 |
| Kawabe et al. 1991, Geochem. J. 25, 31-44. より引用 | Kawabe et al. 1998 Geochem. J. 32, 213-229. より引用 | Kawabe 1995, Geochem. J. 29, 213-230. より引用 |
なぜ、希土類元素存在度パターンに、溶媒抽出のデータに見られたような、四つ組(テトラド)効果が認められたのか?それは、希土類元素存在度パターンの規格化という作業に重要な意味があるからです。「2.希土類元素の地球科学 第2回 規格化」でも少し述べましたが、規格化とは、規格化に用いる物質から対象とする試料に至るまでの何段階かの分配反応過程を見ている事を意味します。つまり、縦軸は溶媒抽出のデータも、地球物質の規格値も、両者ともに分配係数を表している訳です。従って、室内実験でも天然でも四つ組(テトラド)効果が見られるのは別に不思議なことではないと言えます。
さらに、気づかなかった方が多いと思いますが、溶媒抽出のデータも地球物質のデータも、両方縦軸は対数表示をしています。縦軸を対数表示することは大変重要な意味があります。それは、分配係数の対数値(自然対数)に、気体定数Rと温度K(ケルビン)とマイナスをかけると、熱力学量であるギブスの自由エネルギーに対応する (−RT ln K[または−2.303RT log K]= ΔG)ということです。大学の理工系以外の人はすぐ理解できないと思いますが、縦軸を対数表示することにきちんとした理屈があるということを理解して頂ければ結構です。「2.希土類元素の地球科学」で、地球物質の希土類元素存在度パターンは対数表示すべきだと述べたのは、対数表示をしていれば、すぐに熱力学量と対応できるからに他なりません。
しかし、分析機器や分析技術の向上により、地球物質に四つ組(テトラド)効果が現れるのは至極当たり前のこととなりました(Bau, 1996, Contrib. Mineral. Petrol., 123, 323-333)。もし反論するならば、4つ組効果らしく見える分析誤差が生まれる正しい理屈と正しい論理展開をして頂きたいものです。ただし、欧米の研究者が論文を書かないと、四つ組(テトラド)効果が一般論にならないのはなぜでしょう?
詳しい理論については、後述しますが、直感的にテトラド効果を解釈してみましょう。まず、地球上では(必ずしも地球上に限りませんが)、元素は原子の状態で存在しているよりはむしろ、プラスやマイナスの電荷を持ったイオンとして存在しています。ただし、プラスとマイナスのイオンが互いにくっついた状態で存在していると言った方が正確かもしれません。ランタノイドイオンの場合は、最外殻電子軌道の6s、5dおよび4f電子軌道から合計3個の電子が奪い取られて、3価のイオンとなります。例としてプラセオジム(Pr)の例を下に示しています。元素の振る舞いを理解するためには、第2回希土類元素の電子配置 で説明した原子の電子状態ではなく、このイオンの電子状態が重要になってきます。
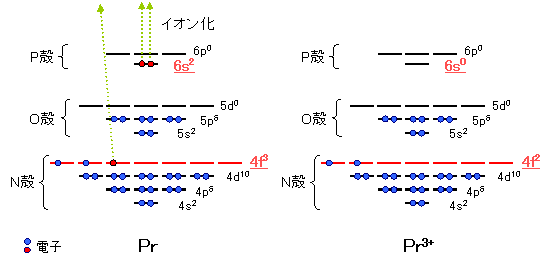
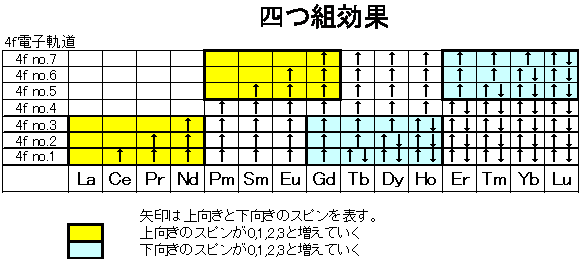
4f電子軌道は全部で7つあります。このとき、La3+(ランタンイオン)からLu3+(ルテチウムイオン)にかけて、4f電子の数が1個ずつきれいに増えていきます。電子の数とスピンの向きがガドリニウムブレイクや四つ組効果と関連があるのです。分かり易く図で見てみましょう。まず、下の図は、ランタノイドを原子番号順に並べ、7つの4f電子軌道に電子がどのような順番で埋まっていくのかを示した図です。La(ランタン)からGd(ガドリニウム)にかけて、上向きのスピンを持つ電子が0個から7個ずつ入っていきます。Gd(ガドリニウム)を超えると今度は、Lu(ルテチウム)に向かって、下向きのスピンを持つ電子が0個から7個ずつ入っていきます。つまり、Gd(ガドリニウム)を中心に電子の数とスピンの向きに左右対称の繰り返し構造があることが分かります。この対称性がGdガドリニウム)ブレイクの原因となります。

一方、四つ組(テトラド)効果の場合は、La-Nd、Pm-Gd、Gd-Ho、Er-Luの4つ毎に、電子の個数とスピンの向きに繰り返し構造があることが原因と分かります。もちろん直感的な説明ですので、なぜPm-Gd組はLa-Nd組よりも常に4個電子の数が多いのに、繰り返し構造なのか?と疑問を持つ人もいると思います。そのような方は是非次の最終章に進んでください。
![]()