last update 2017.01.20
ここでは、希土類元素の原子の構造からテトラド効果まで説明していきます。
原子の構造として、次のような表を見たことはありませんか?
|
軌道の名前 その1 |
K殻 | L殻 | M殻 | N殻 | O殻 |
P殻, Q殻へ と続く |
||||||||||
|
収容できる 電子の最大数 |
2個 | 8個 | 18個 | 32個 | 50個 | |||||||||||
|
軌道の名前 その2 |
1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g | |
|
収容できる 電子の最大数 |
2個 | 2個 | 6個 | 2個 | 6個 | 10個 | 2個 | 6個 | 10個 | 14個 | 2個 | 6個 | 10個 | 14個 | 18個 | |
中学、高校では、原子の構造は陽子や中性子からなる原子核を中心として、同心円上にK殻、L殻、M殻、N殻、O殻・・・があり、それぞれに2個、8個、18個、32個、50個・・・の原子が収納できることを習ったと思います。例えば、水素、酸素などの原子構造は次のように習いませんでたか?
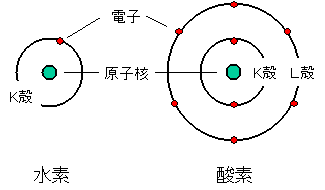
しかし、参考書などには、K殻、L殻、M殻は、さらに1s, 2s, 2p, 3s, ・・・ といったなにやらよく分からない軌道に分けられることが書いてあります。この中に先ほど述べた「4f」という電子軌道があります。いったい電子の構造とはどうなっているのか?について説明していきます。ですが、原子の構造をきちんと理解するためには、量子力学という難しい物理学の知識が必要となります。ここでは、簡略化してかつ概念的に説明していきましょう。
原子の構造を知ろう!という試みは化学者ではなく、物理学者によって行われました。19世紀までは、原子は最小の物質の構成物質であり、それ以上は細かく分けられないというドルトンの原子説のとおりに考えられてきました。しかし、1911年のラザフォードの実験により、原子は原子核と電子によって構成されることが明らかになりました。この研究により、まるで太陽系のように中心の原子核をいくつかの電子が回っているという原子の構造概念ができあがったのです。皆さんよくご存じのK殻、L殻、M殻のイメージはまさにこの通りです。
ですが、この構造のままでは、電子が原子核にあっという間に引き寄せられて、消滅してしまいます。これは大変困った問題ですが、なかなか解決できませんでした。しかし、プランクの量子仮説、ボーアの水素原子構造モデルをへて、シュレディンガー、ハイゼンベルグ、ディラックらきら星のごとくの天才たちによって(このあたりの話はとてもおもしろいのですが、ここでは省略します。)、原子の構造が明らかになってきました。その結果、明瞭な「軌道」というものの上を電子という点が動いているモデルとはまったく異なり、
電子は点ではなく、もやあとした確率の雲で表現される。つまり、電子がこのあたりにいる確率が高いとか低いといった表現で表される(ただし、電子が存在する確率が高い場所をつなげると軌道と思われる形になることはなる、下の図はそうやって描かれた)。

電子はどこにいるんだ?と場所を特定しようとした瞬間に、電子は確率の雲から一つの電子という物質(素粒子)として検出される。
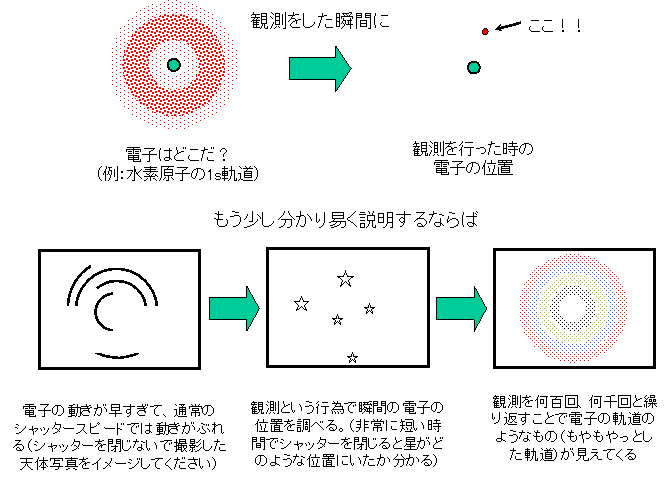
電子は主量子数、方位量子数、磁気運動量、スピンと呼ばれる4つの因子(量子数と呼ばれる)によって、どの軌道にはいるかが決まる。
というように、訳の分からないものということが分かりました。素人の私たちによく分からないのは当然で、天才物理学者であっても、なんだかもやもやした感じがするらしいのです。いずれにしても、ここで同心円状のK殻、L殻、M殻といった軌道からおさらばしてしまいましょう。下に、水素原子が持っている、1s軌道、2s軌道、2p軌道の概念図と、スピンを除く3つの量子数(主量子数、方位量子数、磁気運動量)との関係を示します。ただし、あくまで概念図です。本当にこのような形をしているわけではありません。詳しく知りたい方は量子力学をがんばって勉強しましょう。
量子力学から得られた軌道の概念図(水素原子の軌道)
| K殻 | ||||
| 軌道の概念図 |
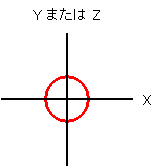 |
|||
| 軌道の名前 | 1s 軌道 | |||
| 主量子数 | 1 | |||
| 方位量子数 | 0 | |||
| 磁気量子数 | 0 | |||
| L殻 | ||||
| 軌道の概念図 |
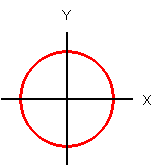 |
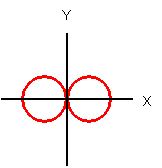 |
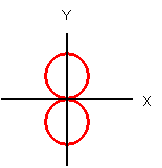 |
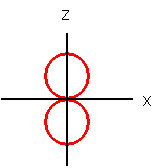 |
| 軌道の名前 |
2s 軌道 (1s 軌道よりも半径が大きい) |
2p 軌道 (2px) | 2p 軌道 (2py) | 2p 軌道 (2pz) |
| 主量子数 | 2 | 2 | 2 | 2 |
| 方位量子数 | 0 | 1 | 1 | 1 |
| 磁気量子数 | 0 | −1と+1 | −1と+1 | 0 |
補足説明:このように、今まで一つの丸い形をしていた軌道は、いくつかの異なる軌道を併せて呼んでいたことが明らかになりました。軌道が異なると量子数はすべて異なります(例えば 2s と 2pzでは、方位量子数が異なります)。一見すると、2px と 2py
は同じ磁気量子数(-1と1)を持っているのに、どうして区別するのか、と思われるかも知れません。これは、詳しくは量子力学を勉強しないとだめなのですが、シュレディンガー方程式と呼ばれる、電子の軌道の形を調べる難しい式を解くと、虚数(i :2乗すると-1になる数)が現れてしまいます。虚数はどうがんばっても、私たちの世界では表すことができません。そこで、目に見える形に表すために、ちょいと細工をしたのが上の図です。磁気量子数が「-1」の軌道を2p−1、磁気量子数が「+1」の軌道を2p+1と表すと、2px と 2pyは次のように導かれます。
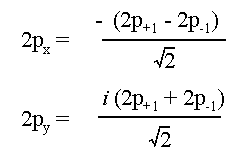
初学の方にはわかりにくいと思いますが、いずれにしても 2px と 2pyは異なる軌道なのです。どうしても納得いかないならば、2pxの磁気量子数は-1で、と
2pyの磁気量子数は+1で、2p軌道はみんな量子数が違うんだと、自分の心の中だけで思って下さい。
さあ、頭は混乱してきていませんか?次は量子数について説明していきます。1s軌道、2s軌道、2p軌道 ・・・ という電子の軌道は、主量子数、方位量子数、磁気量子数の3つの因子によってその特徴が決められました。量子数はこの3つだけでなく、さらにスピンと呼ばれる4つ目の量子数を含めて、電子の軌道が記載されます。では、各量子数の簡単な説明をしていきましょう。
主量子数は「n」という記号で表され、1, 2, 3, 4 ・・・という整数で表されます。数字が大きくなるに従って、軌道をK殻、L殻、M殻、N殻 ・・・と呼びます。 これが我々が高校生までに習う電子の軌道です。主量子数が大きくなるにつれて電子軌道の種類も増えていきますし、軌道の大きさも大きくなっていきます。イメージとしては、駅から住宅までの近さと思ってください。つまり、K殻、L殻、M殻、N殻の順に、原子核から遠くなっていきます。また、主量子数が小さいほど、エネルギーが低く安定しています。つまり、K殻が一番エネルギーが低いため、電子はK殻から率先して入っていきます。エネルギーの大きさは、賃貸住宅の家賃にたとえるとわかりやすいのではないでしょうか。
方位量子数は、「l」という記号で表されます。方位量子数は、主量子数と深い関係があり、
主量子数 n
が 1 の時,
方位量子数
l は 0
主量子数 n
が 2 の時,
方位量子数
l は
0、1の2通り
主量子数 n
が 3 の時,
方位量子数
l は
0、1、2の3通り
以下続く
という関係があります。方位量子数は電子軌道の形の違いを表します。方位量子数が0の時は、主量子数がどんな値でも丸い形をしています(水素原子の1s, 2s軌道)。方位量子数が1の時はお団子状の軌道をしています(p軌道)。2以上になりますと、ずいぶんと複雑になっていきます。イメージとしては、0が1DK、1が2LDK、2が3LDKといった、住宅の間取りと思ってください。
磁気量子数は、「m」という記号で表されます。方位量子数「l」と密接な関係があり、
方位量子数 l
が 0 の時、磁気量子数
m は
0
方位量子数 l
が 1 の時、磁気量子数
m は
0、−1、+1の3通り
方位量子数 l
が 2 の時、磁気量子数
m は
0、−2、+2、−1、+1の5通り
以下続く
という関係があります。磁気量子数は軌道の向きを表します。水素原子の2p軌道は、団子の向きによって3種類ありましたが、これはそれぞれ磁気量子数が異なるからです。イメージとしては、住宅の窓の方位(東西南北)を表すと思ってください。
最後にスピン量子数です。電子はまるで地球の自転のように、ぐるぐると回っています。駒を考えたときに、回転の向きに2通りあることが分かります。それぞれ、トップスピン、ボトムスピンと呼び、数字は中途半端ですが、トップスピンが1/2、ボトムスピンが−1/2という値を取ります。イメージとしては、それぞれ男性、女性と思ってください。
|
さて、原子を構成する電子たちは、結構わがままです。ここで酸素原子についてみていきましょう。酸素原子には8個の電子が入ります。電子は基本的に一人暮らしです(パウリの排他律:一つの軌道{本当は軌道じゃなくて、一つの量子状態}には一つの電子しか入れない)。はじめにやって来た男性の電子(トップスピン)は、一番駅に近く(n=1、 K殻)、間取りは1DK(l = 0、s軌道)がよいと言いました。1DKの部屋は、基本的に南向きの部屋しかありません(m=0)。ここに決めたようです。次に来た電子は、駅に一番近い部屋がまだ一つ残っていますが、スピンは違った値ではないといけないので、女性(ボトムスピン)だけこの物件に入れます。これでK殻に、男性1人、女性1人ずつ二人の電子が入りました。 |
|
|
次に来た男性の電子(トップスピン)は、一番駅に近い部屋(n=1、 K殻)は埋まっているので、しょうがなく、次に駅に近い物件(n=2, L殻)を探しました。一人暮らしなので、間取りは1DK(l=0、s軌道)がよいので、この部屋に入ります。先ほど同様、残りの部屋は女性(ボトムスピン)しか入れないので、残りの部屋は女性が入ります。 |
|
|
次に来た電子は、次に駅に近いものの(n=2, L殻)すでに一人住まいには最適な部屋1DK(l = 0)がもう占められています。しょうがないので、一人身にはちょいと広いですが、2LDKの部屋(l=1、p軌道)に入ります。この物件は窓の向きが、東、南、西の3つ(m = −1, 0, 1)あります。南向きの部屋には男性一人、女性一人ずつしか入れません。2LDKの部屋に入りたがっている電子の数は4つあります。まず、男性だけ南、東、西の部屋に一人ずつ合計3人が入りました。残りの女性は、自分が好きな部屋を選んで入りました。こうして酸素原子の電子の配置が決まりました。どうでしょうか?少しイメージがわきましたか? |
|
![]()