1. 精神神経疾患の包括的メカニズム解明に向けた、ヒト-動物モデル双方向橋渡し研究
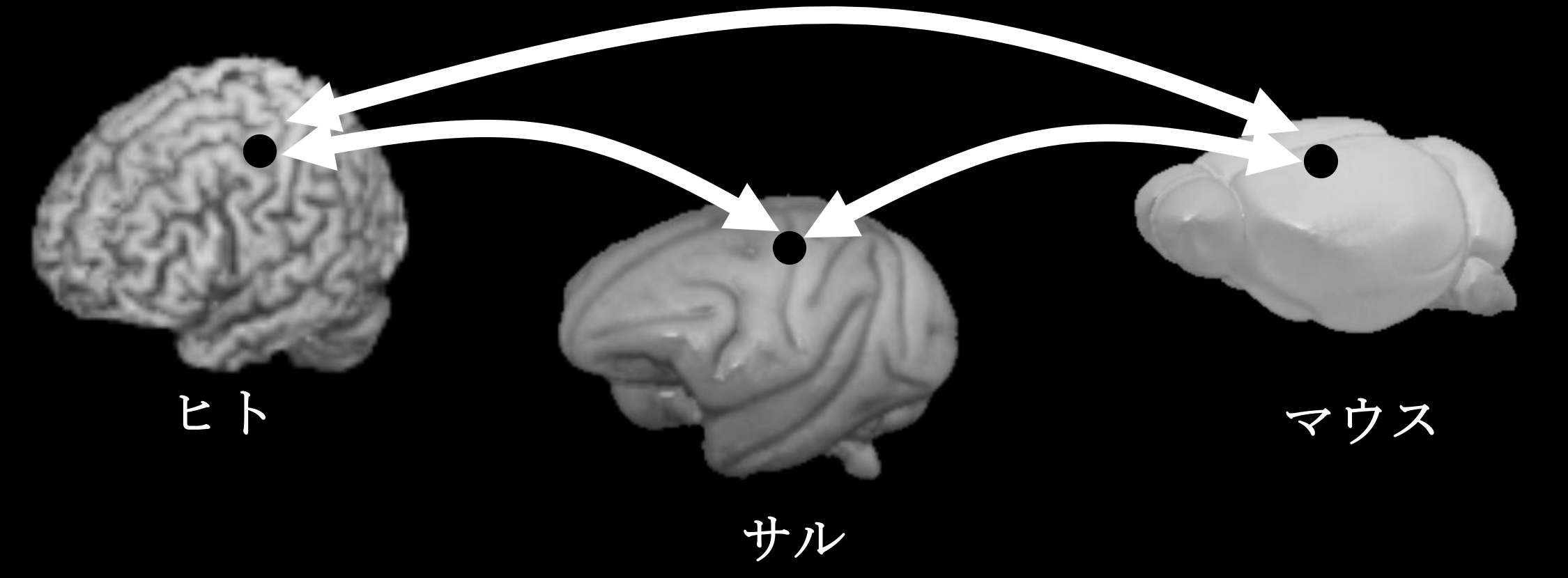
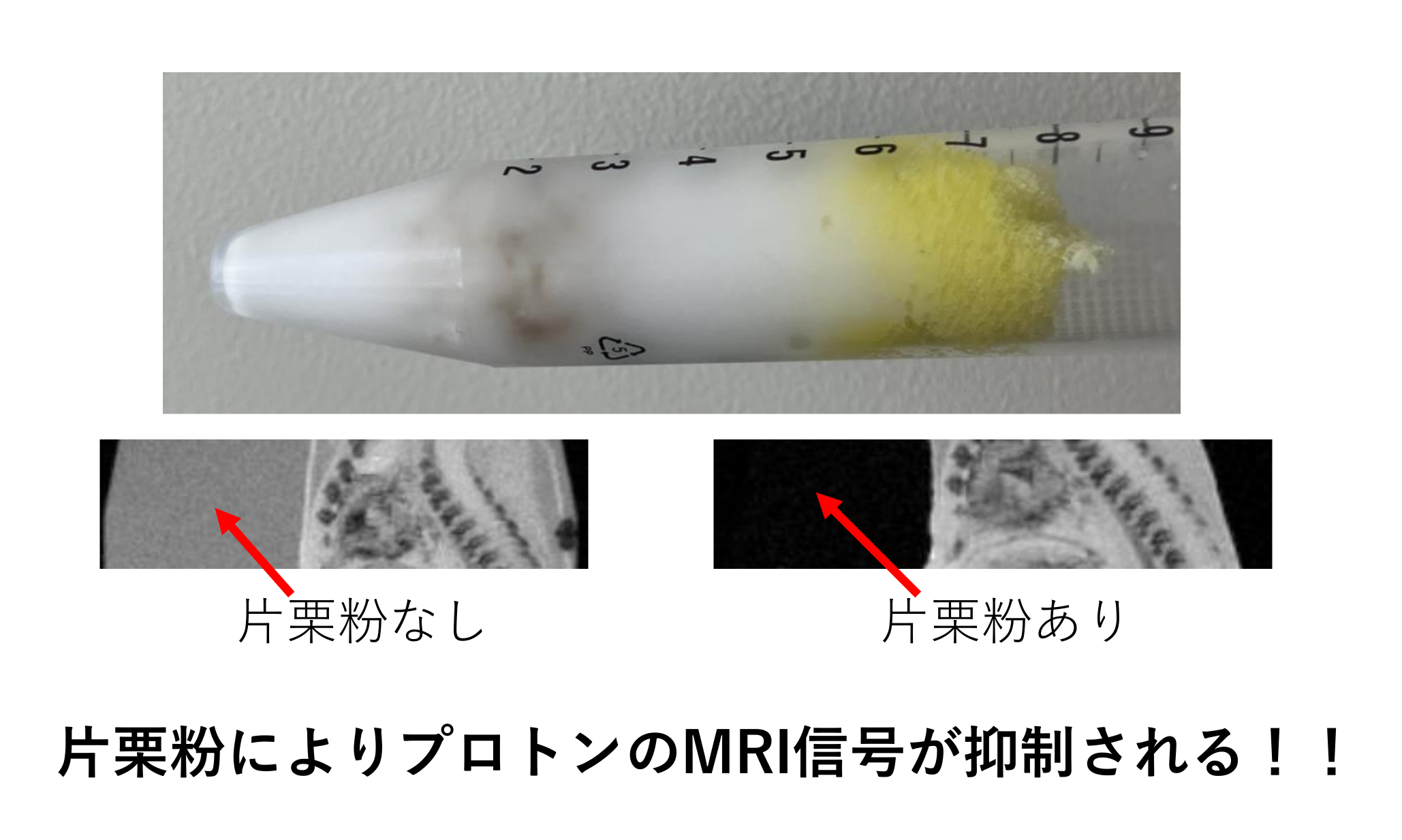
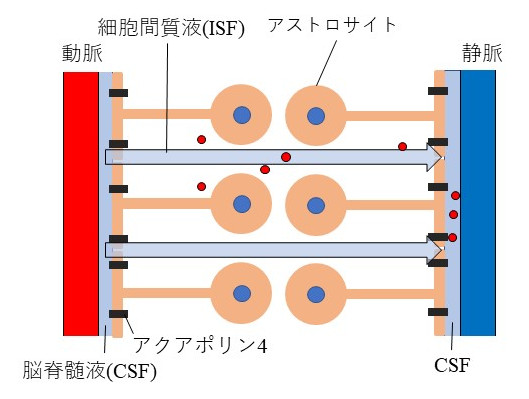
脳疾患のメカニズム研究をするには、疾患モデル動物を用いた包括的研究が必須ですが、我々ヒトと動物をつなぐ研究方法が必要となります。MRIの最大の利点は小動物からヒトまで同じ撮像法で非侵襲的に計測が可能な点です。特に近年の高磁場MRIの発展により、マウスでも200µm以下の解像度で脳機能画像を計測可能になっており、ヒトと動物モデルをつなぐ橋渡し研究として期待されています(Tsurugizawa et al, Sci Rep, 2019; Arimura et al, Front Neural Circuit, 2019; Droguerre etal, Sci Rep, 2019)。一方MRI計測の問題点は、"得られた信号だけではどういった生物学的現象をとらえているか見極めることが難しいこと"です。そこで動物モデルでしかできない神経活動制御(オプトジェネティクス、DREADD、局所電気刺激など)、電気信号計測、免疫抗体染色などの侵襲計測とMRI計測を組み合わせることで、MRI信号変化を神経科学的観点から正確に理解することが可能となります。 本プロジェクトは各々の計測法の利点を最大限に活かし組み合わせることで、脳疾患における脳の機能・構造・代謝異常をMRIを中心とした双方向研究から解明することを目的としています。これまでは、動物モデルを中心に研究を推進していましたが(Nakamura et al, NeuroImage, 2020; Tsurugizawa et al, Sci Adv, 2020など)、今後はヒト・サルのMRI研究を加速し、動物モデルとヒト臨床研究をいかに結びつけるかをテーマに研究を行っていきます。本プロジェクトでは、脳の機能・構造・代謝を高精度で検出するためのMRI画像解析、MRIパルスプログラム作成も行います。