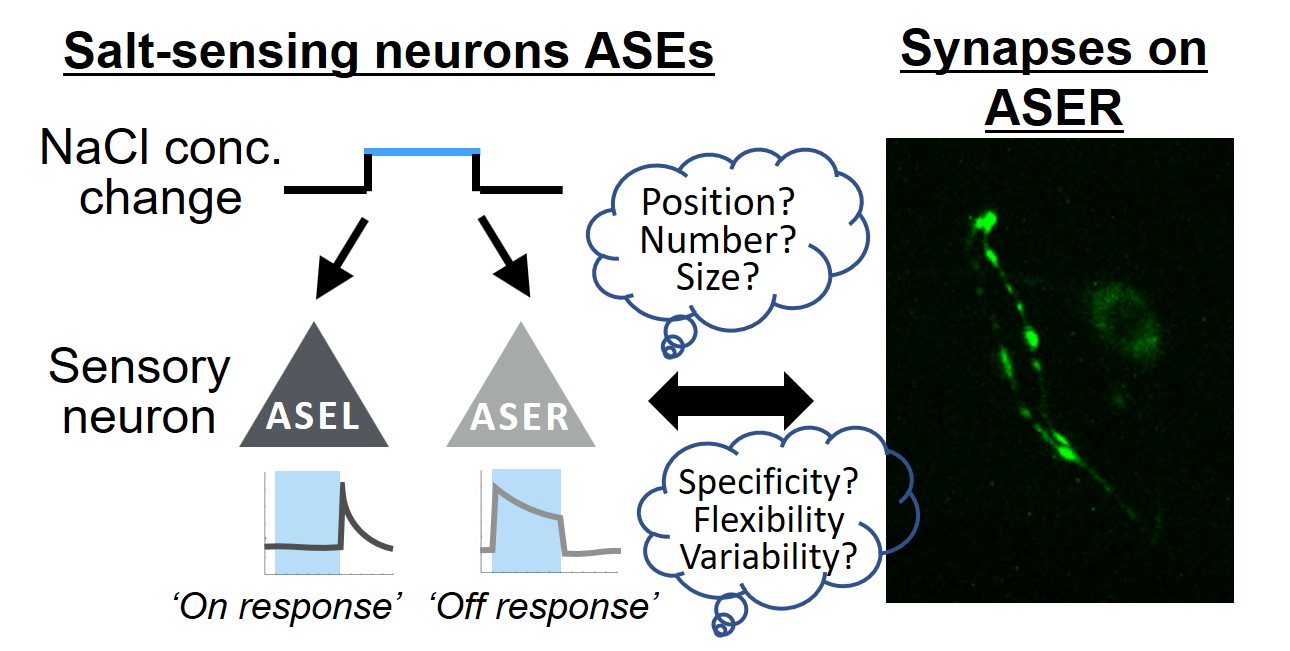
シナプスは、神経細胞間および神経筋接合部の情報伝達を担う特殊構造であり、動物の全ての行動や脳の高次機能発現の最も基本的な構造単位となります。神経回路網を構成する個々のシナプスの形成メカニズムや活動パターンを理解することが、その制御基盤を理解する手掛かりとなります。しかしながら、脳内のシナプスの数や位置、その活動を網羅的に解析し、そこから個体間の行動多様性や脳機能差異を説明することは現在の科学においても不可能です。そこで、哺乳類の脳と比べて単純な神経系を有する線虫を利用し、その神経回路網内に形成されるシナプスの数・位置・活動のパターンと、個々の個体が示す脳機能との相関を見出すことを試みています。並行して、シナプス形成メカニズムの基本原理の解明や、腸内細菌による神経機能や行動制御機構の解明、生体内の神経活動の解析に有益な新規可視化技術の開発にも興味を持って取り組んでいます。
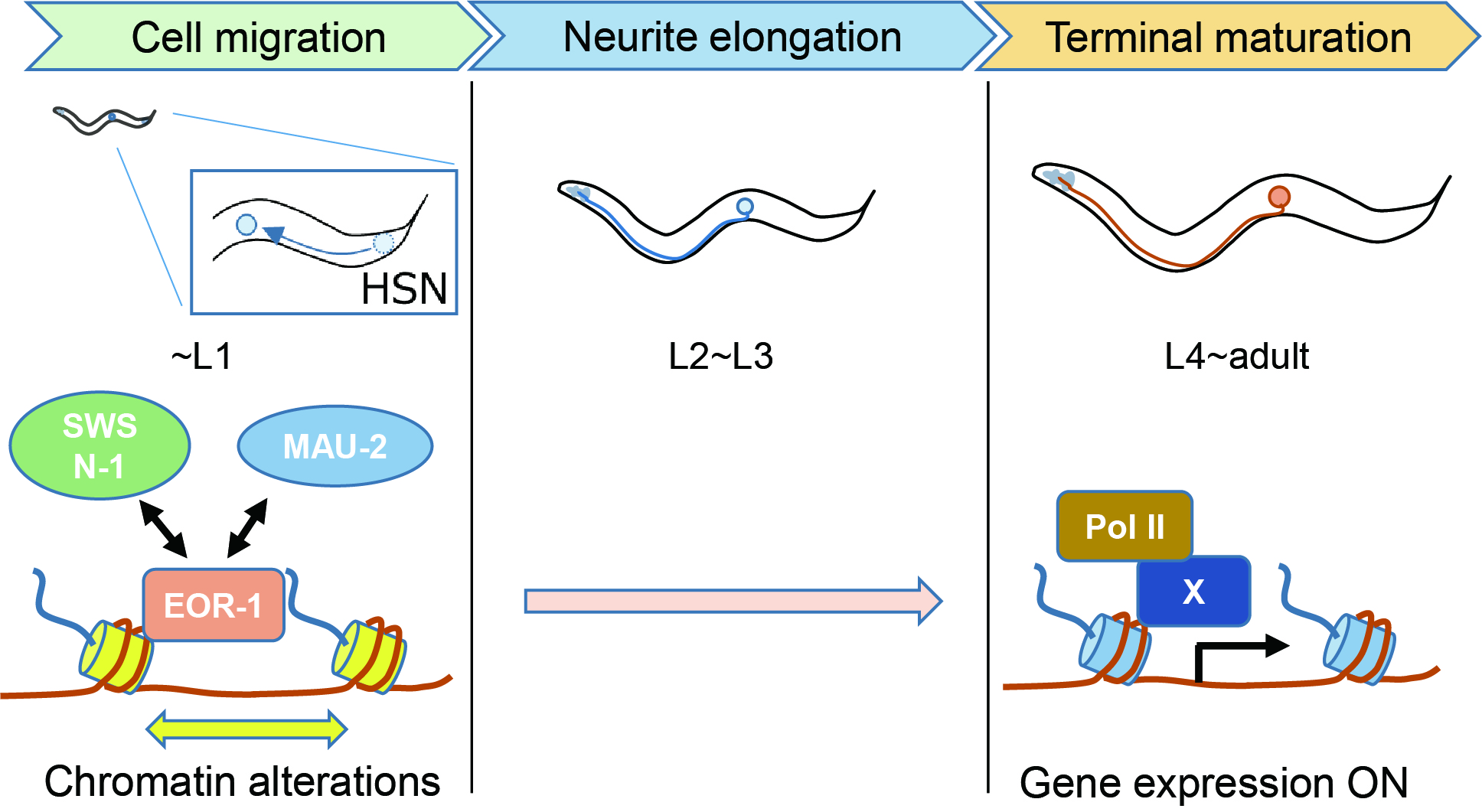
私たちの脳をはじめとする神経系は、様々な個性を持つ神経細胞から構成されています。その個性を確立するための神経成熟過程において、大規模な遺伝子発現変化とそれを裏打ちするエピゲノム情報の書き換えが行われると考えられています。こうしたエピゲノム情報の書き換えの異常は、自閉症スペクトラム障害など様々な疾患を引き起こす要因となっています。私たちは、線虫C. elegansのすべての神経細胞のエピゲノム情報を読み解くことによって、神経個性の全貌や疾患メカニズムを理解しようと挑戦しています。
線虫C. elegansはたったの959個の体細胞によって構成されています。この利点を活かして、全細胞のエピゲノム情報を明らかにし、『一つの受精卵から生まれた様々な個性を持つ細胞の集団が、どのようにして一つの完全なるシステムとしての個体を構築するのか』を明らかにしたいと考えています。そのためのツールとして、これまでにないエピゲノム解析技術の開発に取り組んでいます。
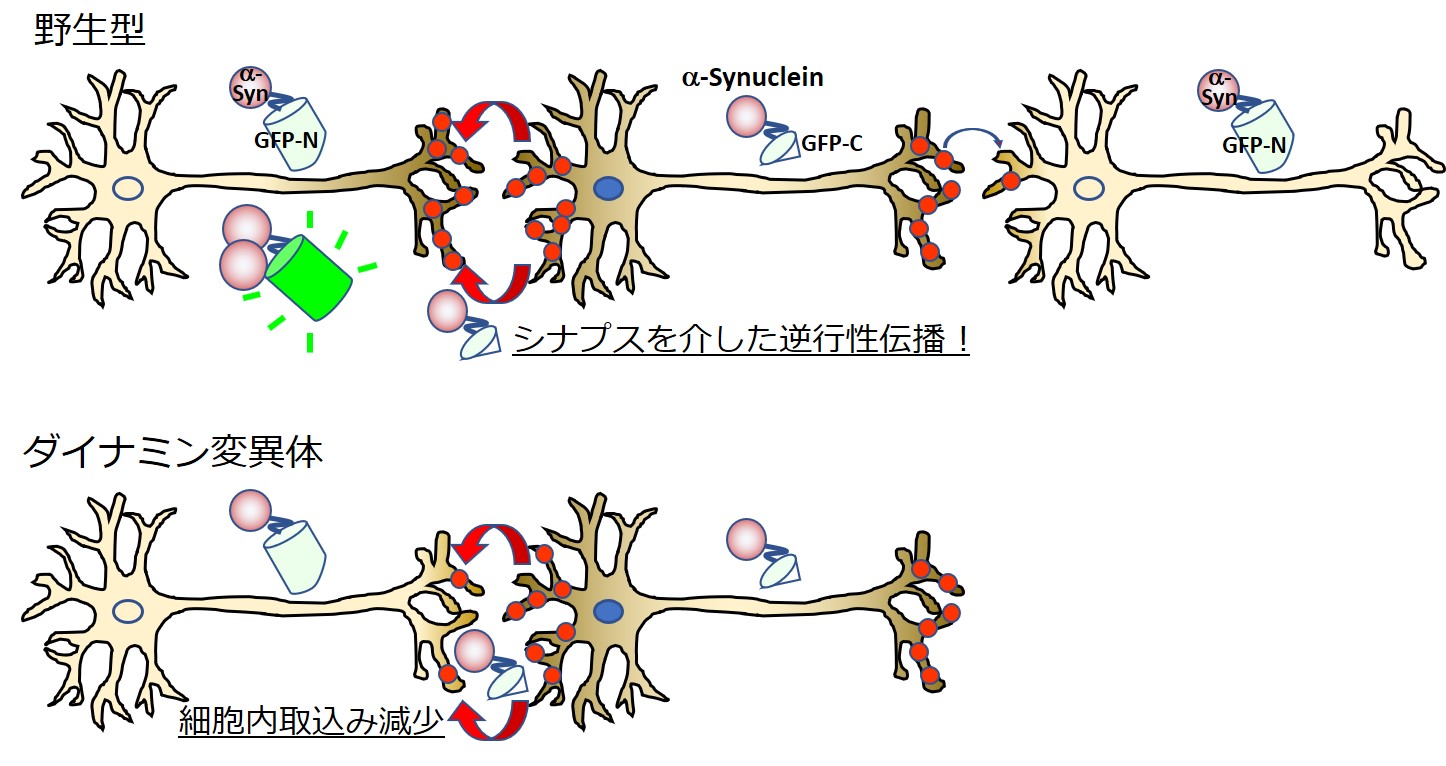
アルツハイマー病やパーキンソン病は、いまだ効果的な治療方法が確立していない神経変性疾患であり、世界中で多くの患者さんやその家族がこれらの病気に苦しんでいます。私たちは、可視化解析の容易な線虫の特性を生かし、これらの疾患発症の主要原因とされるタンパク質を生体内で可視化し、それらのタンパク質の動態変化と神経変性との関係を解き明かすことを試みています。そのために、アルツハイマー病の原因タンパク質であるアミロイドβの凝集状態を容易に判別可能な融合タンパク質を開発したり、パーキンソン病の原因タンパク質であるα-シヌクレインの細胞内伝播を可視化するスプリット型タンパク質を改良したりしています。これらの可視化タンパク質を線虫神経に発現させ、生体内動態に影響を与える因子の探索や解析を行っています。
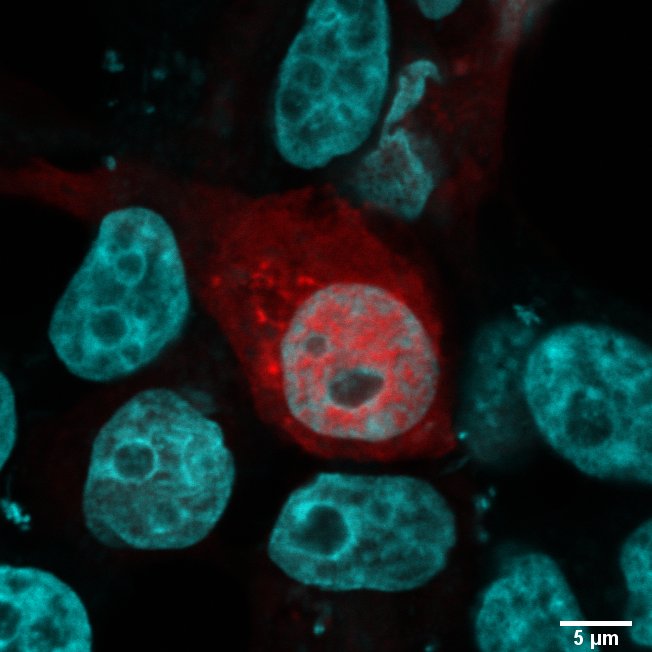
神経変性疾患は、共通して細胞内にタンパク質凝集体を形成します。特に、アミノ酸配列にグルタミンが約40残基以上連続するドメインを持つタンパク質を原因とするポリグルタミン病では、核内に非常に大きな凝集体が蓄積します。こうしたタンパク質凝集体は細胞毒性を有することから、生物にとってこの異常なタンパク質凝集体の核内蓄積から細胞を守るメカニズムが必要です。しかしながら、核内凝集体の分解経路については、未解明の部分が多く残されています。私たちは、殻破りな核内凝集体の分解経路を新たに発見し、その未踏のメカニズムを明らかにしようとしています。

希少難病の発症責任遺伝子やその遺伝子上の変異と、疾患発症との関連を解き明かすために、分子遺伝学的解析やゲノム操作の容易な線虫の特色を生かした解析を行っています。例えば、中心核ミオパチーやシャルコー・マリー・トゥース病、幼児性てんかんなどの原因遺伝子の1つであるダイナミンタンパク質に焦点を当て、患者さんで同定された塩基変異(SNP)をゲノム編集で線虫ゲノムに挿入した疾患モデル動物を網羅的に作成しました。これらの患者型線虫を用いて、実際に疾患発症とリンクしている変異の迅速スクリーニングを可能にし、組織特異的な疾患発症が生じるメカニズムを解明することを試みています。