last update 2008.02.05
はじめに希土類元素の歴史について簡単に紹介しましょう。希土類元素のうち「イットリウム」という元素が1794年にはじめに分離されてから、1907年に最後の元素として「ルテチウム」という元素が発見されます。すべての元素を分離し、個々の元素を確認するのになんと100年以上も要したのです。これは、希土類元素は互いに非常によく似た性質を持ち、分離するのが困難なためでした。このため、希土類元素の発見の歴史と名前の由来については、 なかなかおもしろい話があるのですが、本シリーズでは省略させて頂きます。
高校生までの化学では希土類元素についてはほとんどふれませんが、科学や工学の世界では様々な発見やおもしろい性質がどんどん見つかるなど、大変注目を浴びている元素なのです。アイウエオ順に主な用途について書き上げてみると、色々と身近なところでがんばっていることが分かります。特にライターの火打ち石やテレビのブラウン管に希土類元素が入っているって皆さん知っていましたか?
さて、身近な用途を確認したところで、次は希土類元素が地球上にどのような形で存在しているかをご紹介しましょう。希土類元素には「希(まれ)」という字がついていますが、地球上での存在量は決して少ないわけではありません(一部の元素は確かに希ですが)。たとえば、亜鉛やコバルトといった有名どころの元素と同じくらいの存在量があります。
希土類元素を含む鉱物は100種類以上も知られていますが、資源として有効なものは5つほどです。なじみが薄い鉱物がほとんどですが、以下に主なものを挙げてみます。一部の鉱物には化学式も書き込んでみました。Fe(鉄)などの皆さんご存じの元素以外の元素記号は、REE:希土類元素、Th:トリウム(放射性元素)、Be:ベリリウム(エメラルドやアクアマリンの中に入っています)を表します。
・・・、私も聞いたことがない鉱物がほとんどです。ちなみに日本には有望な鉱床はありません。主な産出国は、中国、アメリカ、旧ソ連、オーストラリア、インドなどです。岩石の中に濃集している鉱床もありますが、川底の特定の場所に集まって形成された鉱床がかなり重要な産地となっています。これは、岩石が風化してぼろぼろになったあと、雨などで川に流された希土類元素の鉱物が、比重が大きい(重い)ため、水流などによって特定の場所に固まって分布するためです。
岩石としては、墓石などでよく使われる花崗岩やその仲間のペグマタイトという岩石に希土類元素は多く含まれます。ペグマタイトはマグマの残りかすが固まった岩石です。大きな石英の結晶(水晶のこと)などが岩石の中の空洞部分にできていたりします。希土類元素など通常の岩石にはあまり濃集しない元素をたくさん含んでいます。大陸では、炭酸カルシウムをたくさん含む火成岩(地下や地表のマグマ活動でできた岩石)やナトリウム-カリウムを多く含むアルカリ岩という火成岩に多く含まれています。
歴史と産状の次は、希土類元素を化学的に見てゆくことにしましょう。まずは周期律表から見てゆきます。
|
1 (1A) |
2 (2A) |
3 (3A) |
4 (4A) |
5 (5A) |
6 (6A) |
7 (7A) |
8 (8) |
9 (8) |
10 (8) |
11 (1B) |
12 (2B) |
13 (3B) |
14 (4B) |
15 (5B) |
16 (6B) |
17 (7B) |
18 (0) |
|
| 1 |
H |
He | ||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Ba | L* | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | BI | Po | At | Rn |
| 7 | Fr | Ra | A* |
| L* | ランタノイド | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| A* | アクチノイド | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
H(水素)、He(ヘリウム)に始まり、最初の方は皆さんご存じの元素ばかりです。希土類元素とは、周期律表に黄色で示した17元素のことを表します。今まで聞いたことのない元素ばかりですね。しかも、高校生の時にはよく分からなかった、はみ出しものの「ランタノイド」という元素群を含んでいます。下に、希土類元素の一覧表を作ってみました。舌をかみそうな名前ばかりですね。この中で、Pm(プロメチウム)は放射性元素で、自然の状態では地球上には存在しません。太陽系形成初期には存在したのですが、放射壊変によって別の元素に変わってしまったのです。
希土類元素一覧
| 原子番号 | 原子記号 | 元素名 | 原子番号 | 原子記号 | 元素名 |
| 21 | Sc | スカンジウム | 64 | Gd | ガドリニウム |
| 39 | Y | イットリウム | 65 | Tb | テルビウム |
| 57 | La | ランタン | 66 | Dy | ジスプロシウム |
| 58 | Ce | セリウム | 67 | Ho | ホルミウム |
| 59 | Pr | プラセオジム | 68 | Er | エルビウム |
| 60 | Nd | ネオジム | 69 | Tm | ツリウム |
| 61 | Pm | プロメチウム | 70 | Yb | イッテルビウム |
| 62 | Sm | サマリウム | 71 | Lu | ルテチウム |
| 63 | Eu | ユウロピウム |
周期律表の一つの枠にはただ1つの元素が入ることが前提ですが、ランタノイド元素とアクチノイド元素は例外です。この理由については、周期律表の生みの親であるメンデレーエフの頭を大いに悩ませました。周期律表の縦に並んでいる元素は、互いによく似た性質を持つことは、高校で習ったと思います。典型元素については、周期律表の縦に並んでいる原子の構造は、最外殻電子数が同じという共通した構造を持つためです。つまり、原子の化学的な性質は、最外殻電子によって決まるわけです。希土類元素についても同様ですが、一番上のスカンジウム(Sc)は、地球化学的にはどちらかといえばイットリウム(Y)やランタノイドよりも、むしろ第1遷移金属元素(たとえば鉄など)とよく似た性質を示すことが多いようです。では、一つの枠に入っているランタノイド元素同士ではどうでしょうか?ご想像の通り、周期律表の縦に並んでいる元素同士の関係よりも遙かに性質が似ているのです。希土類元素発見の歴史に100年もかかったのはこのためです。
しかし、なぜ希土類元素のうち、ランタノイドと呼ばれる元素は周期律表の一つの枠に15元素もぎゅうぎゅうと入り込んでいるのでしょうか?これは、メンデレーエフが生きていた当時ではわからなかった、4f電子によるものです。いきなり難しい単語が出てきましたが、これは原子(というよりも、電子の配置)の構造を表した言葉です。希土類元素の化学的な挙動を知るためには、どうしても原子の構造について知識が必要となります。この点については、「第3章.希土類元素の物理化学」で説明していきます。
ここで、次の章に進む前に少しだけ補足説明をします。それは「希土類元素」という名称についてです。「希土類元素」という名称は、原則スカンジウム、イットリウム、ランタノイド(ランタンからルテチウムまで)の17元素すべてのことを指します。しかし、実際にはランタノイドだけに対しても「希土類元素」と呼ぶことが多いようです。この説明では混乱しないように、希土類元素といえば、スカンジウム、イットリウム、ランタノイドの17元素すべてを指し、ランタノイドはランタノイドと呼びます。ちなみに
正しい使い方:イットリウムは希土類元素である。
スカンジウムは希土類元素に含まれる。
この本では、ランタノイドを希土類元素と呼ぶことにする。
間違った使い方:希土類元素とはランタノイドのことを指す。
鉄やコバルトなどの遷移金属元素と同じように、希土類元素(とくにランタノイド)の金属は磁性(常磁性)を持っています。元素によって磁性を持ったり持たなかったりするのは、不対電子が関係しています。不対電子とは、奇数個の電子をもつ元素や分子、又は偶数個の電子を持つ場合でも電子軌道の数が多くて一つの軌道に電子が一つしか入らない場合のことを言います。鉄やコバルトなどの遷移金属元素はM殻(正確には3d軌道)に不対電子があるためで、希土類元素は、N殻(正確には4f軌道)に不対電子があるためです。特にネオジム(Nd)やサマリウム(Sm)を使った磁石は史上最強の磁石で有名です(足立吟也,1999,希土類の科学,化学同人,896p.)。
今は希土類系の磁石が圧倒的な特性で、大量に生産されて、目立たないところで使われています。最近はNdFeBに替わる新材料が見つからず、低調です。唯一SmFeN磁石が有望視されましたが、窒化物ですので、焼結ができないため、ボンド磁石としてしか使えません。希土類磁石は中国資源に頼る状態ですので、日本の工業の将来を考えると非希土類系の磁石開発が望まれますが、かなり悲観的です。環境問題からハイブリッドタイプの自動車がかなり増えそうで、これに対応するNdFeB磁石にはDy(ジスプロシウム)添加が必須ですので、Dy(ジスプロシウム)問題はかなり深刻になっています。国家プロジェクトにも取り上げられ、添加量を小量にできるようにはなってきているようです(KKさん私信[一部改],2008.1.20)
| 代表的な希土類元素磁石 | ||||
| 磁石 | 特徴 | 飽和磁化(T) | 異方性磁界(MAm−1) | キュリー温度(K) |
| SmCo5磁石 | 初めて実用化された永久磁石。ただし、Smは高価なのが欠点。 | 1.14 | 23.0 | 1000 |
| Sm2Co17磁石 | キュリー温度高く熱的に安定。 | 1.25 | 5.2 | 1193 |
| Nd2Fe14B磁石 | 安価なNdを使用。ただし、熱的に不安定で酸化されやすい。 | 1.60 | 5.3 | 586 |
| Sm2Fe17N3磁石* | SmFeはソフト磁性だが、Nを入れることでハード磁性になるという極めて面白い事象を示す。 | 1.57 | 21.0 | 747 |
*NdFeBと同じく日本で開発され(旭化成ですが)、製造も住友金属鉱山がトップで頑張っています。窒化物にするために、粉末しかできないので、ボンド磁石(樹脂で固めたもの)として使われています。住友金属鉱山がボンド磁石用のコンパウンドを販売しています(KKさん私信[一部改],2008.1.9)。
電気陰性度は原子がどの程度電子を強く引きつけるかを表す目安で、ポーリングという人がはじめに提唱しました。はじめは半経験的な方法で求められたのですが、その後マリケンによって、量子力学的な観点から再定義されました。大まかには次のような化学的な関係があります。
電気陰性度が大きい : 電子を強く引きつける : 陰イオンになりやすい
電気陰性度が小さい : 電子を引きつける力が弱い : 陽イオンになりやすい
希土類元素の電気陰性度は、アルカリ・アルカリ土類元素と同じくらいかその次に小さくなっています(ポーリングが出した値)。そのため、非常に反応性が高く、イオン結合性が強い特徴を示します。電気陰性度の大きさは、スカンジウム、イットリウム、ランタノイドの順に小さくなります(鈴木,1998,希土類の話,裳華房,171p.)。
| 周期 | 元素 |
電気 陰性度 |
元素 |
電気 陰性度 |
元素 |
電気 陰性度 |
| 2 | Li | 0.97 | Be | 1.47 | ||
| 3 | Na | 1.01 | Mg | 1.23 | ||
| 4 | K | 0.91 | Ca | 1.04 | Sc | 1.2 |
| 5 | Rb | 0.89 | Sr | 0.99 | Y | 1.11 |
| 6 | Cs | 0.86 | Ba | 0.97 | L* | 下記参照 |
| 7 | Fr | 0.86 | Ra | 0.97 | A* |
| ランタノイド | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| 電気陰性度 | 1.08 | 1.08 | 1.07 | 1.07 | 1.07 | 1.07 | 1.01 | 1.11 | 1.10 | 1.10 | 1.10 | 1.11 | 1.11 | 1.06 | 1.14 |
希土類元素は最外殻電子が3つ余っているので、イオンになると3価の陽イオンになります。ほかの元素で3価の陽イオンになるのは、アルミニウム(Al)、鉄(Fe)、クロム(Cr)などがありますが、スカンジウムイオンと3価の鉄イオンの関係を除くとあまり互いに似た挙動を示しません。原子の挙動は、最外殻電子だけで決まらないのは、最外殻以外の軌道に入ってる電子が悪さをするためで、電子軌道をきちんと理解しなといけません。
ところが、希土類元素も17元素も集まればおかしな者もいくつか出てきます。基本的に希土類元素は3価の陽イオンになるのですが、ほかに2価や4価の陽イオンになることもあります。たとえばセリウム(Ce)は時々4価、ユウロピウム(Eu)は2価の陽イオンになることがあります。なぜでしょう?地球科学ではセリウム(Ce)やユウロピウム(Eu)が4価や2価を取ることに着目して、昔の環境が酸化的だったか(酸素がたくさんあったか)、還元的だったか(酸素が少なかったか)を議論します。この点については、「第2章.希土類元素の地球科学」で説明します。
希土類元素のイオンは半分近くが無色ですが、残りは非常にきれいな色をしています。また、色の付き方にはある規則性があり、4f電子軌道の不対電子の数が同じイオン同士は似た色(全く同じではないですが)を示します(鈴木,1998,希土類の話,裳華房,171p.)。
| 二価イオン | 色 | 三価イオン | 色 | ||||
| Sm2+ | 赤血色 | Sc3+ | 無色 | ||||
| Eu2+ | 無色 | Y3+ | 無色 | ||||
| Yb2+ | 黄色 | ||||||
| 三価イオン | 色 | 4f電子数 |
不対 電子数 |
三価イオン | 色 | 4f電子数 |
不対 電子数 |
| La3+ | 無色 | 0 | 0 | Tb3+ | 無色 | 8 | 6 |
| Ce3+ | 無色 | 1 | 1 | Dy3+ | 淡黄色 | 9 | 5 |
| Pr3+ | 緑色 | 2 | 2 | Ho3+ | 淡橙色 | 10 | 4 |
| Nd3+ | 紫色 | 3 | 3 | Er3+ | ピンク | 11 | 3 |
| Pm3+ | 橙色 | 4 | 4 | Tm3+ | 淡緑色 | 12 | 2 |
| Sm3+ | 橙色 | 5 | 5 | Yb3+ | 無色 | 13 | 1 |
| Eu3+ | 無色 | 6 | 6 | Lu3+ | 無色 | 14 | 0 |
| Gd3+ | 無色 | 7 | 7 |
イオンの振る舞いには、イオンの価数だけでなく、イオン半径というものが重要な役割を果たします。おおざっぱな議論ですが、イオン結合性が高い元素の化学的な挙動は、イオンの価数とイオン半径という二つのパラメーターで説明できることが多いのです。ですが、やっかいなことにイオン半径というのは、有名な物理化学量であるにも関わらず、ぴったりこれ!!!という値がないのです。それは、単独のイオンを取り出して、その半径を測定することが不可能だからです。ではどのようして測定するというと、もっとも代表的なやり方は、元素の酸化物、フッ化物、塩化物などの比較的単純な化合物にX線をあてて、陽イオンと陰イオンの間の距離を丹念に測定し、そこから酸素イオン、フッ素イオン、塩素イオンのイオン半径をさっ引くわけです。基本的には、酸素イオンの大きさを基準に求められます。
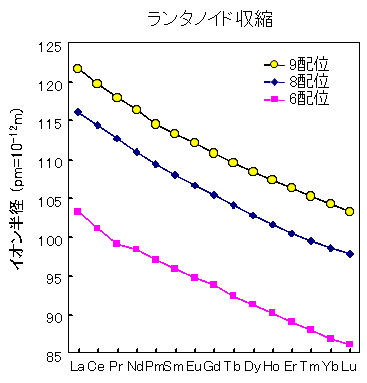
希土類元素は、数多くの元素の中でもイオン結合性の高い元素です。ところが、またまたやっかいなことに、イオン結合性の高い元素であっても、多少共有結合性がありますし、陽イオンの周りに陰イオンがどのように取り巻いているか(これを配位状態といい、取り囲んでいる陰イオンの数を配位数といいます)によって、値がどんどん異なってきます。そのために、イオン半径には、必ず配位数ごとに異なる値が示されているのです。だいたい多くの教科書に載っているイオン半径は、6配位か8配位が多いようです。希土類元素イオンは他の元素のイオンに比べて大きく、6, 7, 8, 9, 10, 11, 12, 14配位まで様々な配位数を取ります。
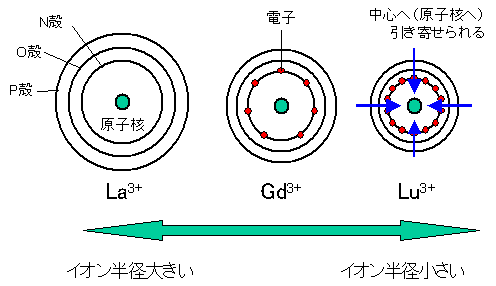
希土類元素のうち、ランタノイドは原子番号が大きくなると、イオン半径が単調に減少してきます。このことをランタニド収縮と呼びます。同じ様なことが、ウランやトリウムといった放射性元素を多く含むアクチノイド属にも見られます。通常の原子は電子番号が大きくなると外側の軌道にどんどん電子が入っていくのですが、遷移金属元素はなぜか不思議なことに、内側の電子軌道に電子が入っていくのです。鉄やマンガンといった有名どころの遷移金属元素は、一つ内側の軌道に電子が入るのですが、ランタノイドの場合は、不思議なことに一番外側の電子軌道であるP殻からさらに二つ内側のN殻に電子が入っていくのです。当然P殻よりもN殻の方が原子核に近いので、電子がたくさんN殻にはいるほど、原子核の方へぐぐぐぐぐと引き寄せられてしまいます。この結果として、ランタニド収縮が引き起こされるのです。
| 元素 | 価数 | イオン半径(pm=10−12m) | ||
| 6配位 | 8配位 | 9配位 | ||
| Sc | 3+ | 74.5 | 87.0 | - |
| Y | 3+ | 90 | 101.9 | 107.5 |
| La | 3+ | 103.2 | 116 | 121.6 |
| Ce | 3+, 4+ |
101 (87:IV) |
114.3 (97:IV) |
119.6 (-:IV) |
| Pr | 3+, (4+) | 99 | 112.6 | 117.9 |
| Nd | (2+), 3+ | 98.3 | 110.9 | 116.3 |
| Pm | 3+ | 97 | 109.3 | 114.4 |
| Sm | 3+ | 95.8 | 107.9 | 113.2 |
| Eu | 2+, 3+ |
94.7 (117:II) |
106.6 (125:II) |
112.0 (130:II) |
| Gd | 3+ | 93.8 | 105.3 | 110.7 |
| Tb | 3+, (4+) | 92.3 | 104.0 | 109.5 |
| Dy | 3+ | 91.2 | 102.7 | 108.3 |
| Ho | 3+ | 90.1 | 101.5 | 107.2 |
| Er | 3+ | 89.0 | 100.4 | 106.2 |
| Tm | (2+), 3+ | 88.0 | 99.4 | 105.2 |
| Yb | (2+), 3+ | 86.8 | 98.5 | 104.2 |
| Lu | 3+ | 86.1 | 97.7 | 103.2 |
括弧の中は3価の陽イオン以外のイオン半径の値です(足立吟也,1999,希土類の科学,化学同人,896p.)。II, IVはイオンの価数を表しています。4価のイオンは3価のイオンよりも小さく(セリウム)、2価のイオンは3価のイオンよりも大きくなっています(ユウロピウム)。
<3価の希土類元素イオンのイオン半径>
希土類元素イオンは、pH 5以下ではほとんど加水分解しません。pH=1くらいでも加水分解してしまう鉄イオン(3価の鉄イオン)に比べると、我慢強い元素です。ではどのくらいまでpHを上げると沈殿するのかというと、実験条件によって違いますが、軽希土類元素、重希土類元素、スカンジウムの順に沈殿しやすくなります(下図参照)。ちなみに、4価のセリウム(Ce(IV))はルテチウムよりも遙かに低いpHで沈殿し、2価のユウロピウム(Eu(II))はアルカリ土類元素並みに高いpHで沈殿します。
3.gif)
データは鈴木,1998,希土類の話,裳華房,171p.より引用
平たく言うと、ほとんど毒性がないと考えられています。希土類元素の試薬を作っている会社や私を含め研究所などで、希土類元素を食べて死んだ人はいません。最も、どんな元素でも大量に摂取すれば毒になりますので(塩もとりすぎると高血圧になるだけではすまされない)、全く毒性がないわけではありませんが、銅・亜鉛・鉛などの金属元素に比べるとずっと毒性は低いと思われます。
![]()