アパタイト(歯や骨の主要無機成分)など、ある種のリン酸カルシウム層を生体材料の表面に形成させると、その材料はもはや生体から異物として認識されず(異物反応を回避できる)、周囲の組織と良くなじむようになります。つまり、リン酸カルシウム層の表面形成によって材料の生体親和性を向上させることができ、生体材料としての機能を高めることができます。 たとえば、生分解性高分子の多孔体の表面にアパタイト層を形成させると、細胞の増殖が促進され、骨を作る機能を持った細胞へと速やかに変化(骨分化)します。このようなアパタイト複合体は、骨組織を再生するための足場材料(スキャホールド)として有用と期待されます。
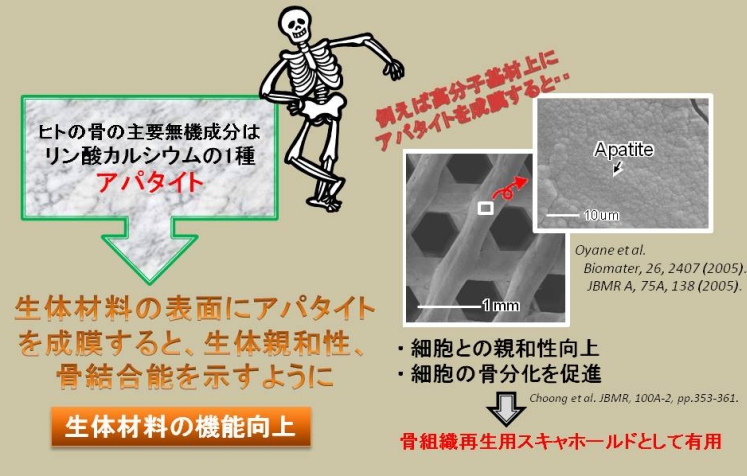
基盤技術(1):アモルファスリン酸カルシウム(ACP)を利用したアパタイト成膜技術
[ACP-assisted biomimetic process]
私たちは、様々なアパタイト形成法の中でも、常温、常圧、中性水溶液というマイルドな成膜環境を特徴とするバイオミメティック法に着目しています。私たちの開発したバイオメティック法では、まずはじめに、材料の表面にアパタイトの前駆体であるアモルファスリン酸カルシウム(ACP)のナノ粒子を導入します(左/中図)。次に、この材料を、アパタイトに対して過飽和なリン酸カルシウム水溶液(コーティング液)に浸漬します(右図)。すると、材料表面のACPがアパタイトの核形成を誘起し、過飽和溶液中のイオンやリン酸カルシウムクラスターを取り込みながら、自発的に成長していきます。浸漬24時間後には、厚さ数ミクロンのアパタイト層が材料の全面に形成されます。この手法は、種々の金属、高分子、およびセラミックス基材に適用することができます。
この研究は、NEDO平成15年度産業技術研究助成事業、およびJST平成18年度シーズ発掘試験の助成を受けて実施されました。
この技術の歯周治療応用研究を、JSPS科研費の助成を受け、北海道大学大学院歯学研究院の宮治裕史先生のグループと共同で実施しています。
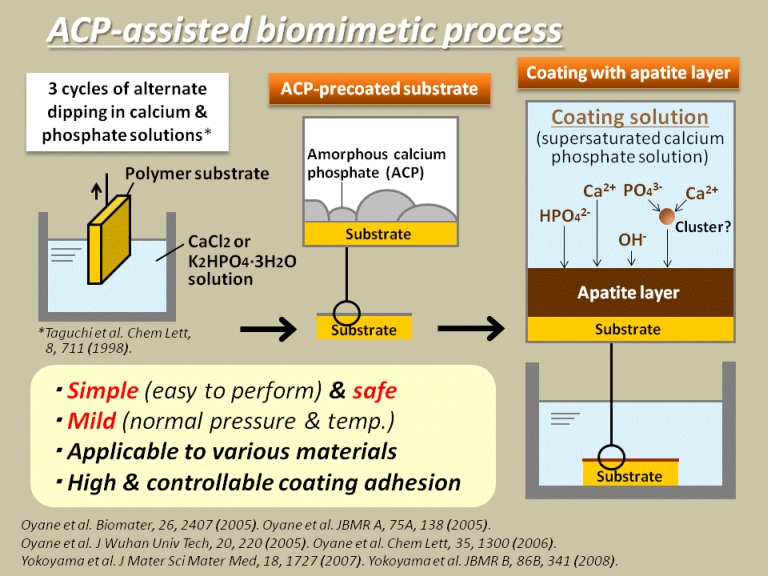
基盤技術(2):液相レーザープロセスを利用したアパタイト成膜技術
[Laser-assisted biomimetic process]
私たちは近年、過飽和液相レーザープロセスを利用して、より迅速なバイオミメティック法の開発に取り組んでいます。この手法によれば、生体材料表面の目的の部位に、簡便かつ短時間内にリン酸カルシウムを形成させることができます。このような手法は、研究現場や医療現場でも手軽に利用可能な成膜技術として有用と期待されます。
この成膜技術は、光化学技術振興財団、村田学術振興財団、天田財団、およびJSPS科研費の助成を受けて開発されました。
この技術の歯周治療応用研究を、JSPS科研費の助成を受け、北海道大学大学院歯学研究院の宮治裕史先生のグループと共同で実施しています。
ACP-assisted biomimetic processにおいて、コーティング液にタンパク質、DNA、抗菌剤といった機能分子を添加しておくと、機能分子とアパタイトのナノ複合層を形成させることができます。たとえば、細胞接着因子であるラミニン(タンパク質の一種)をコーティング液に添加すると、アパタイト結晶からなるマトリックス中にラミニン分子が担持されたナノ複合層が形成されます(右上図)。この複合層中のラミニンの生理機能(細胞接着活性)は失活していません。その証拠に、ラミニン-アパタイト複合層の表面に細胞をまくと、ラミニンを担持させていないアパタイト層の上に比べてより強固に細胞が接着します。
私たちはこのような機能分子―アパタイト複合層の形成技術を利用して、安全で高効率な遺伝子導入システム、細菌感染を防ぐ経皮デバイス(皮膚を貫通して使用される医療用具)、骨形成を促進する人工骨などの開発を進めています。
応用研究(1):遺伝子導入システムの開発
特定の機能を待たない未分化な細胞が、何らかの機能(例えば骨を作る機能)を獲得することを細胞分化と言います。iPS細胞やES細胞など、未分化な細胞を得る技術は確立されつつあります。これらの未分化な細胞を生体内または生体外で分化させて、様々な機能を発揮できるように誘導するための技術が求められています。細胞の分化を誘導するための技術のひとつに遺伝子導入があります。私たちは上で紹介したアパタイト形成技術(ACP-assisted biomimetic process)を利用して、DNAを、種々の機能分子(細胞接着因子、脂質、抗体)と共にアパタイト層中に担持させ、遺伝子導入用基材として応用してきました。私たちの開発したDNA-機能分子-アパタイト複合層による遺伝子導入システムでは、DNAのみをアパタイト層中に担持させたシステムに対し、1桁~2桁高い導入効率を達成しています。
詳しくは、無機マテリアル学会誌 Vol. 19, 466 (2012) 、Acta Biomaterialia (10.1016/j.actbio.2012.02.003) をご覧ください。

この研究は、主に新世代研究所の助成(2006年度)を受けて実施されました。
応用研究(2):遺伝子導入のコントロール
私たちは、DNA-細胞接着因子-アパタイト複合層の構造を制御することによって、遺伝子導入の時間的コントロール、場所特異的遺伝子導入、細胞特異的遺伝子導入を行うための技術を開発しました。
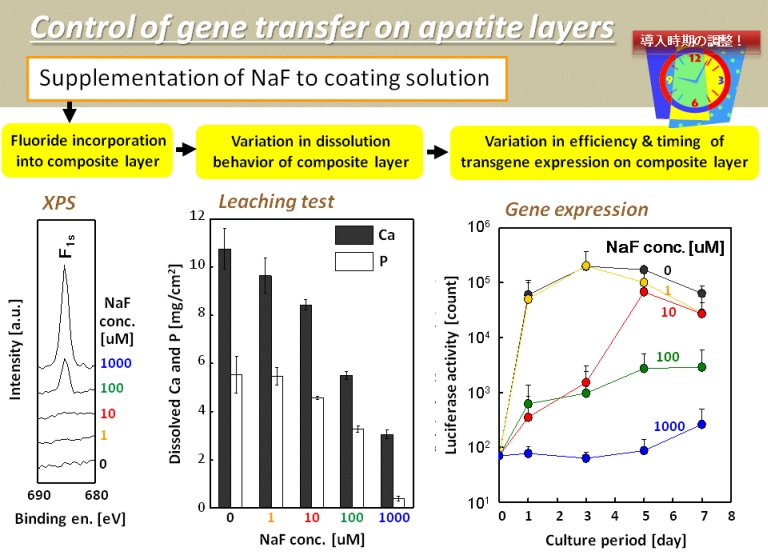
遺伝子導入の時間的コントロールに関する研究成果の一例を示します。まず、ACP-assisted biomimetic processにより複合層を形成させる際、コーティング液に種々の濃度のフッ化物イオンを添加することによって、アパタイトの水酸化物イオンの一部をフッ化物イオンで置換しました。その結果、複合層の溶解性が低減し(中図)、これにより同層表面における遺伝子導入のタイミングが遅延しました(右図)。このような技術により、目的の遺伝子を意図したタイミングで細胞に導入することができれば、細胞の効率的な分化誘導に役立つと期待されます。
詳しくは、Biomaterials Vol. 32, 4896 (2011) をご覧ください。
この研究は、イオン工学振興財団およびJSPS科研費の助成を受けて実施されました。
応用研究(3):遺伝子導入システムの再生医療応用
DNA-機能分子-アパタイト複合層による遺伝子導入システムを利用して、実際に細胞の分化を誘導したり、組織を再生したりすることができます。たとえば、神経成長因子のDNAを担持させた複合層の上で未分化な神経様細胞(PC12細胞)を培養したところ、複合層からの遺伝子導入によって、この細胞が神経様細胞に分化しました(右図)。
同じように、骨形成タンパク質-2(BMP-2)の遺伝子を含む複合層の上では、骨芽細胞様細胞(MC3T3-E1細胞)の骨分化が促進されました。さらに、この複合層を人工骨の表面に形成させてラットの骨欠損部に埋入したところ、周辺部の骨形成が促進されました。このように、細胞の分化を誘導して目的の組織を再生させる技術は、再生医療における重要な要素技術です。
骨分化の研究については、J. Biomed. Sci., Vol. 18, 62 (2011)、およびBiomed. Mater., Vol. 6, 45004 (2011)をご覧ください。
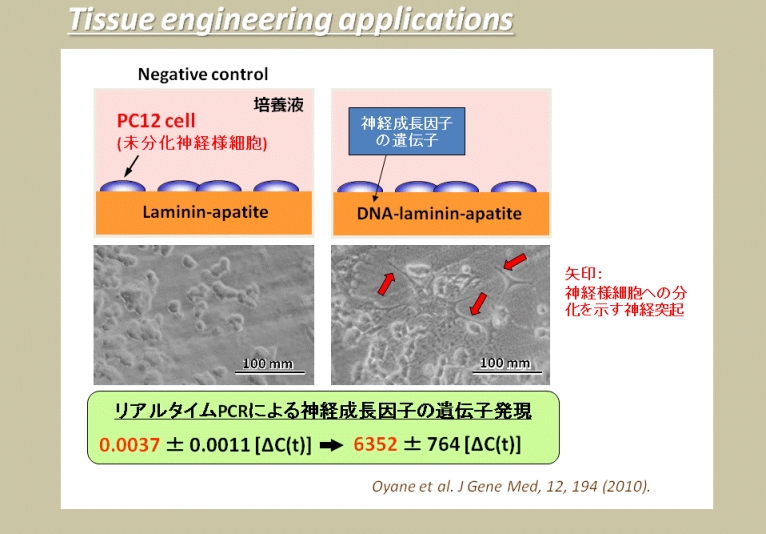
この研究は、JSPS科研費の助成を受けて実施されました。
応用研究(4):経皮デバイスの開発
骨折治療用の創外固定具やカテーテル、人工歯根などのように、皮膚を貫通して使用される医療用具(経皮デバイス)における最大のリスクは、周囲の組織との密着不良などから引き起こされる細菌感染です。私たちは、人工材料の表面に接着因子、成長因子、抗菌剤から選ばれる1種以上の機能分子を担持させることにより、細菌感染防止機能を有する経皮デバイスを開発してきました。各機能分子を失活させることなく人工材料の表面に担持させるための条件を明らかにし、細胞や生体組織との相互作用について基礎的検討を行うとともに、経皮デバイスとしての有用性を動物実験により実証してきました。
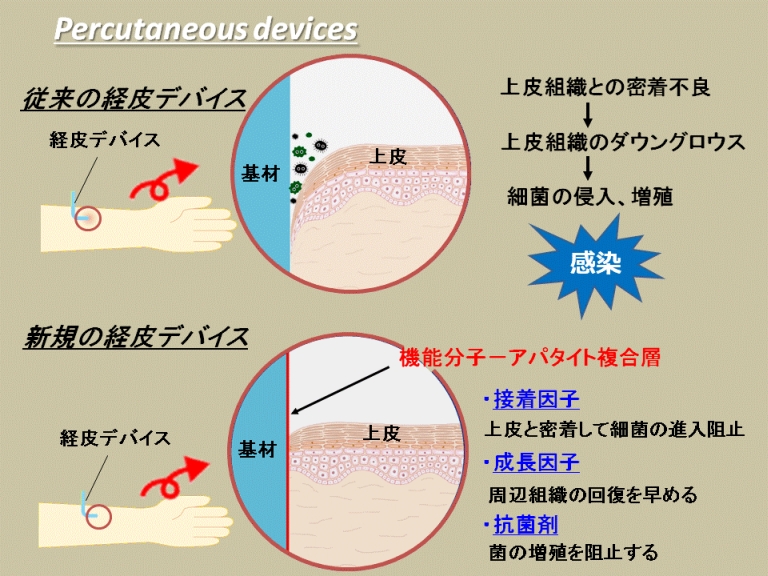
この研究は、NEDO平成17年度産業技術研究助成事業などの助成を受けて、産総研のヒューマンライフテクノロジー研究部門(現 健康工学研究部門)、筑波大学、茨城県立医療大学、早稲田大学、および東北大学と共同で実施されました。 さらに詳細な条件検討・動物実験を経て、現在、筑波大学等において臨床研究が進められています。
バイオミメティック法とは?
バイオミメティック(biomimetic)とは「生体模倣」を意味します。
私たちの骨は、アパタイトに対して過飽和* な体液中で、コラーゲン線維の上にアパタイトの微結晶が析出することによって作られています。体液に類似した過飽和溶液を、化学試薬と水から合成することができます。そのような過飽和溶液の代表例が、擬似体液(Kokubo et al. Biomaterials, Vol. 27 (2006) 2907)です。過飽和溶液の中に、アパタイト形成に有利な表面** を持つ基材を浸漬すると、基材上にアパタイトを形成させることができます。このような技術は、バイオミメティック法(あるいは過飽和溶液法)と呼ばれています。
* その温度における飽和濃度以上に、成分イオンが溶け込んでいる状態。
** アパタイトの前駆体、ある種の官能基(Si-OH, Ti-OH, COOHなど)、ある種のタンパク質などを有する表面。
DNAとは?
核酸の一種、DeoxyriboNucleic Acid(デオキシリボ核酸)を指します。4種類の塩基(アデニン、グアニン、シトシン、チミン)とデオキシリボース(糖)とリン酸から構成される有機高分子で、通常は細胞の核の中に存在します。
DNA分子には、上記の4種類の塩基の並び順という形で、生物の遺伝情報が詰め込まれています。この遺伝情報をもとに、生物の営みに必要なタンパク質が合成されています。遺伝子導入技術を用いると、目的の遺伝情報(塩基の並び順)を有するDNA(またはRNA)を細胞内に送り込み、目的のタンパク質を発現させることができます。
